„FastKing gDNA“ išsklaido „RT SuperMix“
funkcijos
■ Greitas: vienas veiksmas, skirtas genomo pašalinimui ir efektyviai atvirkštinei transkripcijai atlikti per 18 minučių, tik pridedant šablonus.
■ Didelis efektyvumas: atvirkštinė transkriptazė modifikuojama hidrofobiniu motyvu, o RT efektyvumas viršija 95%.
■ Paprasta ir lengva: išskirtinė termiškai jautri DNazė turi greitą efektą, didelį efektyvumą, trumpesnį reakcijos laiką ir neturės įtakos cDNR.
Specifikacija
Tipas: Geno modifikuota atvirkštinė transkriptazė, gDNazė
Procedūros: Vienas žingsnis (genomo DNR pašalinimas ir RT)
RT efektyvumas: > 95%
Šablonas: 1 ng- 2 μg
Veikimo laikas: ~ 18 min
Programos: Atvirkštinė transkribuota cDNR gali būti naudojama įprastame PGR, realaus laiko PGR, cDNR bibliotekos konstrukcijoje, SAGE (serijos genų ekspresijos analizė), pradmenų pratęsime ir kituose įprastiniuose eksperimentuose.
Visi produktai gali būti pritaikyti ODM/OEM. Norėdami gauti daugiau informacijos,spustelėkite individualų aptarnavimą (ODM/OEM)
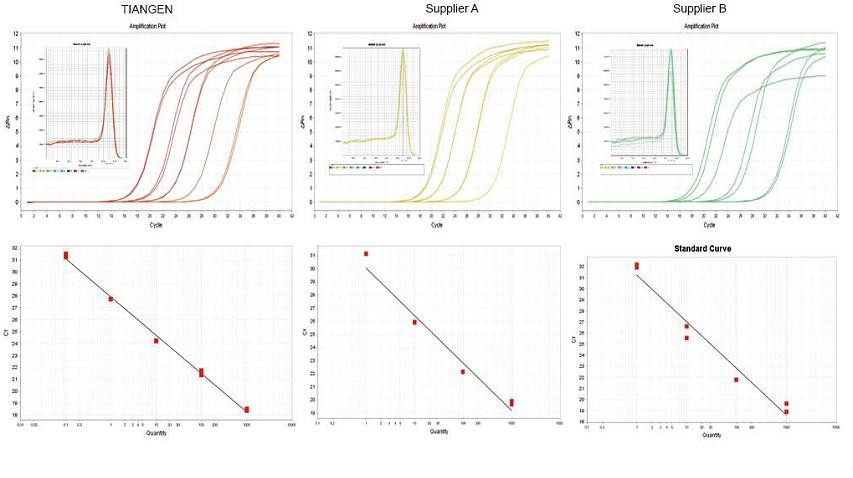 |
Eksperimentinis pavyzdys 1. cDNR buvo susintetinta naudojant vieno žingsnio atvirkštinius kiekybinius reagentus iš TIANGEN FastKing gDNA Dispelling RT SuperMix, atitinkamai A tiekėjo ir B tiekėjo. Naudodami „TIANGEN Talent qPCR PreMix“ („SYBR Green“) nustatykite pelių RN5 geną, buvo išanalizuota amplifikacijos kreivė, lydymosi kreivė ir standartinė kreivė. Rezultatai rodo, kad „TIANGEN FastKing gDNA Dispelling RT SuperMix“ turi didžiausią kiekybinę Ct vertę po atvirkštinės transkripcijos ir puikų atsparumą stresui, ir turi akivaizdžių pranašumų šablonams su didelėmis priemaišų liekanomis. |
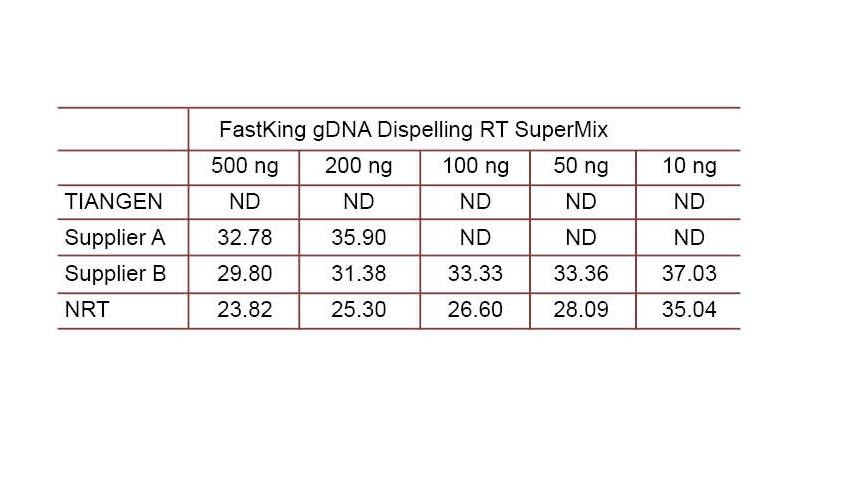 |
Eksperimentinis pavyzdys 2. cDNR buvo susintetinta naudojant vieno žingsnio atvirkštinius kiekybinius reagentus iš „TIANGEN FastKing gDNA Dispelling RT SuperMix“, atitinkamų produktų tiekėjo A ir tiekėjo B, atitinkamai. Aptikite žmogaus HsG geną naudodami „TIANGEN Talent qPCR PreMix“ („SYBR Green“) ir rankiniu būdu pridėkite skirtingas genomo DNR koncentracijas, kad nustatytumėte skirtingų reagentų gDNR pašalinimo galimybes. Ct rezultatai rodo, kad „TIANGEN FastKing gDNA Dispelling RT SuperMix“ puikiai pašalina genomo DNR. Puikiai gali būti pašalinta iki 500 ng genomo DNR liekanų, nepaveikiant rezultatų. ND: neaptiktas. NRT: mišinio aptikimas be atvirkštinės transkripcijos. |
A-1 RNR yra suskaidyta
—— Išvalykite aukštos kokybės RNR be užteršimo. Medžiaga, iš kurios išgaunama RNR, turėtų būti kuo šviežesnė, kad būtų išvengta RNR skilimo. Prieš RT reakciją išanalizuokite RNR vientisumą denatūruotame gelyje. Po RNR ekstrahavimo jį reikia laikyti 100% formamide. Jei naudojamas RNazės inhibitorius, kaitinimo temperatūra turi būti <45 ° C, o pH - mažesnis nei 8,0, kitaip inhibitorius išskiria visą surištą RNazę. Be to, RNazės inhibitorių reikia įpilti į tirpalus, kuriuose yra ≥ 0,8 mM DTT.
A-2 RNR yra atvirkštinės transkripcijos reakcijų inhibitoriai
—— Atvirkštinės transkripcijos inhibitoriai yra SDS, EDTA, glicerolis, natrio pirofosfatas, spermidinas, formamidas, guanidino druska ir kt. Sumaišykite kontrolinę RNR su mėginiu ir palyginkite išeigą su kontroline RNR reakcija, kad patikrintumėte, ar yra inhibitorius. Nuplaukite RNR nuosėdas 70% (v/v) etanoliu, kad pašalintumėte inhibitorius.
A-3 Nepakankamas pradmenų, naudojamų pirmai cDNR grandinei sintetinti, atkaitinimas
—— Nustatykite, ar atkaitinimo temperatūra tinka eksperimente naudojamiems pradmenims. Atsitiktiniams heksamerams rekomenduojama palaikyti 25 ° C temperatūrą 10 minučių prieš pasiekiant reakcijos temperatūrą. Norėdami gauti specifinių genų pradmenų (GSP), išbandykite kitą GSP arba perjunkite į oligo (dT) arba atsitiktinį heksamerą.
A-4 Nedidelis pradinės RNR kiekis
- Padidinkite RNR kiekį. Jei RNR mėginiai yra mažesni nei 50 ng, pirmosios grandinės cDNR sintezei galima naudoti 0,1–0,5 μg acetilo BSA
A-5 Tikslinė seka nėra išreikšta analizuojamuose audiniuose.
- Išbandykite kitus audinius.
A-6 PGR reakcija nepavyksta
—— Dviejų pakopų RT-PGR atveju cDNR šablonas PGR žingsnyje negali viršyti 1/5 reakcijos tūrio.
A-1 Nespecifinis gruntų ir šablonų atkaitinimas
-Pradmenų 3'-gale neturėtų būti 2-3 dG arba dC. Pirmoje grandinės sintezėje naudokite genų specifinius pradmenis, o ne atsitiktinius pradmenis ar oligo (dT). Pirmuosiuose cikluose naudokite aukštesnę atkaitinimo temperatūrą, o vėliau - žemesnę. Norėdami pagerinti reakcijos specifiškumą, PGR naudokite karšto paleidimo Taq DNR polimerazę.
A-2 Blogas specifinių genų pradmenų dizainas
—— Laikykitės tų pačių amplifikacijos pradmenų projektavimo principų.
A-3 RNR, užteršta genomine DNR
——RNR apdorokite PGR laipsnio DNaze I. Nustatykite kontrolinę reakciją be atvirkštinės transkripcijos, kad nustatytumėte DNR užterštumą.
A-4 Grunto dimerio formavimas
—— Sukurkite pradmenis be papildomų sekų 3 'gale.
A-5 Per didelis Mg2+ koncentracija
- Optimizuokite Mg2+ kiekvieno šablono ir pradmenų derinio koncentracija
A-6 Užterštas svetima DNR
—— Naudokite aerozoliams atsparius antgalius ir UDG fermentus.
A-1 Pirmosios grandinės produkto kiekis yra per didelis
—— Sumažinkite pirmosios grandinės produkto kiekį įprastu PGR reakcijos etapu.
A-2 Per didelis pradmenų kiekis PGR reakcijoje
- Sumažinkite pradmenų įvedimą.
A-3 Per daug ciklų
—— Optimizuokite PGR reakcijos sąlygas ir sumažinkite PGR ciklo skaičių.
A-4 Per žema atkaitinimo temperatūra
-Padidinkite atkaitinimo temperatūrą, kad išvengtumėte nespecifinio inicijavimo ir pratęsimo.
A-5 Nespecifinis oligonukleotidų fragmentų amplifikacija, susidaranti dėl DNazės DNR skilimo-išgaukite aukštos kokybės RNR, kad išvengtumėte DNR užteršimo.
RT-PCR yra RNR transkripcija į cDNR, o tada atvirkštinė transkribuota cDNR naudojama kaip šablonas PGR reakcijai, siekiant sustiprinti tikslinį fragmentą. Pasirinkite atsitiktinius pradmenis, „Oligo dT“ ir genų specifinius pradmenis pagal konkrečias eksperimento sąlygas. Visi aukščiau išvardyti pradmenys gali būti naudojami trumpai eukariotinių ląstelių mRNR be plaukų segtuko struktūrai.
Atsitiktinis gruntas: Tinka ilgajai RNR su plaukų segtuko struktūra, taip pat visų rūšių RNR, pvz., RRNR, mRNR, tRNR ir kt. Jie daugiausia naudojami vieno šablono RT-PGR reakcijai.
Oligo dT: tinka RNR su PolyA uodegomis (prokariotinė RNR, eukariotinė Oligo dT rRNR ir tRNR neturi PolyA uodegų). Kadangi „Oligo dT“ yra surištas su „PolyA“ uodega, reikalaujama, kad RNR mėginių kokybė būtų aukšta, ir net nedidelis skilimas labai sumažins viso ilgio cDNR sintezės kiekį.
Genui būdingas pradmuo: papildo šablono seką, tinka situacijoms, kai tikslinė seka yra žinoma.
Yra du būdai:
1. Vidinis pamatinis metodas: teoriškai cDNR yra įvairaus ilgio DNR fragmentai, todėl elektroforezės rezultatas yra tepinėlis. Jei RNR yra nedaug, joks produktas nebus rodomas elektroforezėje, tačiau tai nereiškia, kad nė vienas produktas nebus sustiprintas PGR. Apskritai, vidinė nuoroda gali būti naudojama aptikti cDNR. Jei vidinė nuoroda turi rezultatų, cDNR kokybė gali būti iš esmės garantuota (kai kuriais atvejais, jei tikslinis geno fragmentas yra per ilgas, gali būti išimčių).
2. Jei yra žinomas genas, sustiprintas šiuo šablonu, tai galima patikrinti šio geno pradmenimis. Vidinės nuorodos sustiprinimas nebūtinai reiškia, kad nėra problemų su cDNR. Kadangi vidinė nuoroda turi daug cDNR, ją lengva sustiprinti. Jei dėl įvairių priežasčių cDNR yra iš dalies suskaidyta, tikimybės požiūriu, tai turės didelės įtakos mažo gausos tikslinių genų PGR rezultatams. Nors vidinės nuorodos vis dar yra daug, stiprinimas greičiausiai neturės įtakos.
Iš dalies susilpnina RNR. Nustatykite RNR vientisumą ir išvalykite
Skirtingų rūšių RNR turinys gali būti skirtingas, tačiau apskritai, išgautoje bendroje RNR gelio elektroforezėje turėtų būti dvi aiškios 28S ir 18S juostos, o pirmosios juostos ryškumas turėtų būti dvigubai didesnis nei pastarosios. 5S juosta rodo, kad RNR buvo suskaidyta, o jos ryškumas yra proporcingas skilimo laipsniui. Sėkmingas vidinės nuorodos amplifikacija nereiškia, kad nėra problemų su RNR, nes vidinė nuoroda yra labai gausi, RNR gali būti amplifikuojama tol, kol skaidymas nėra stiprus. OD260/OD280grynos RNR santykis, išmatuotas spektrofotometru, turėtų būti nuo 1,9 iki 2,1. Mažas baltymų priemaišų kiekis RNR sumažins santykį. Kol vertė nėra per maža, RT nebus paveikta. Svarbiausia RT yra RNR vientisumas.
Vidinio etaloninio geno išplėtimas gali tik parodyti, kad RT pavyko, tačiau tai nebūtinai yra susiję su cDNR grandinės kokybe. Kadangi vidiniai etaloniniai fragmentai paprastai yra mažo dydžio ir didelės išraiškos, jiems lengviau sekasi atlikti atvirkštinę transkripciją. Tačiau tikslinio geno dydis ir išraiška įvairiuose genuose skiriasi. Apie cDNR kokybę negalima spręsti tik remiantis vidine nuoroda, ypač tikslinių fragmentų, ilgesnių nei 2 kb.
Kai kurie mėginiai turi sudėtingas antrines struktūras arba turi didelį GC kiekį arba yra brangūs ir jų nedaug. Tokiais atvejais reikia pasirinkti tinkamą atvirkštinę transkriptazę, atsižvelgiant į tikslinio fragmento ir mėginio dydį. RNR šablonams, turintiems didelį GC kiekį ir sudėtingą antrinę struktūrą, sunku atidaryti antrinę struktūrą žemoje temperatūroje arba naudojant įprastą atvirkštinę transkriptazę. Šiems šablonams galima pasirinkti kiekybinę atvirkštinę transkriptazę, nes jos atvirkštinės transkripcijos našumas akivaizdžiai yra geresnis nei M-MLV serijos atvirkštinės transkriptazės, kuri gali efektyviai pakeisti įvairius RNR šablonus ir maksimaliai perrašyti RNR į pirmąją cDNR grandinę. Naudojant bendrą atvirkštinės transkriptazės rinkinį, 20 μl sistema gali efektyviai pakeisti tik 1 μg visos RNR. Atkreipkite dėmesį į maksimalią komplekto RT talpą. Jei šablono pridedama per daug, atvirkštinė transkripcija bus palanki dideliam RNR kiekiui. Todėl geriau neviršyti maksimalios sistemos talpos.
A-1 Nustatykite, ar RNR yra labai suskaidyta ir ar RT yra sėkmingas
Apskritai vidinio etaloninio stiprinimo nesėkmės priežastis dažnai sukelia rimtas RNR degradacija. Kita galima priežastis yra atvirkštinės transkripcijos nesėkmė. Vidinė nuoroda negali būti naudojama kaip standartas, siekiant įvertinti vienos grandinės cDNR kokybę, tačiau ji gali būti naudojama kaip standartas, siekiant įvertinti, ar atvirkštinė transkripcija yra sėkminga, jei nėra RNR kokybės problemų. Svarbiausias dalykas atvirkštinės transkripcijos procese yra palaikyti pastovią temperatūrą ir pastovią reakcijos sistemą, siekiant pagerinti reakcijos efektyvumą.
A-2 Nustatykite, ar vidiniai etaloninių genų amplifikavimo pradmenys yra patikimi ir ar yra kokių nors problemų su reagentais, naudojamais PGR.
Santykiniam kiekybiniam nustatymui RNR turi būti kiekybiškai įvertintas prieš atvirkštinę transkripciją, kuri taip pat reikalinga daugelyje atvirkštinės transkripcijos rinkinių, pavyzdžiui, kiekybiškai įvertinkite RNR įvestį kaip 1 μg. Kadangi atvirkščiai transkribuota cDNR yra mišrus tirpalas, įskaitant RNR, oligo dT, fermentą, dNTP ir net šiek tiek DNR likučių, bus sukeltas nukrypimas, todėl neįmanoma tiksliai nustatyti cDNR. Todėl RNR kiekybinis nustatymas yra būtinas. Atsižvelgiant į tai, kad atvirkštinės transkripcijos efektyvumas skirtinguose mėginiuose yra vienodas, gautas cDNR kiekis turėtų būti vienodas, o kiekybinė analizė gali parodyti skirtingų genų ekspresijos lygių palyginimą tuo pačiu visos RNR kiekiu. Atliekant santykinį fluorescencinį kiekybinį PGR, po atvirkštinės transkripcijos gali būti nereikalinga kiekybinė cDNR, nes vidinis etaloninis genas gali būti naudojamas kaip atskaitos taškas.
Tai daugiausia susiję su genais, o atvirkštinė ilgų fragmentų transkripcija neįmanoma daugeliui genų. Pirma, atvirkštinės transkripcijos efektyvumas yra daug mažesnis nei PGR. Antra, GC turtingas regionas ir daugelio genų antrinė struktūra riboja tiek atvirkštinę transkripciją, tiek PGR. Galiausiai sunku garantuoti PGR ištikimybę ir stiprinimo efektyvumą tuo pačiu metu. Atvirkštinės transkripcijos procese niekas negali garantuoti, kad gaus ilgą fragmentą mažos kopijos genams, ypač naudojant oligo dT. Kalbant apie 5 'UTR su daugiau GC, tai dar sunkiau. Todėl vis dar yra pagrįstas būdas pakeisti transkripciją atsitiktiniais pradmenimis, surasti natūralias skilimo vietas tiksliniame fragmente, sustiprinti segmentais ir tada atlikti restrikcijos skaidymą ir perrišimą. Apskritai sunku tiesiogiai amplifikuoti didesnius nei 2 kb fragmentus, tačiau ne visada neįmanoma: 1. Visų pirma garantuoti RNR/mRNR vientisumą, todėl pageidautina TRIZOL ekstrahavimas. 2. M-MLV RT-PCR rinkinys gali būti tiesiogiai naudojamas. Prailginkite atkaitinimo laiką ir tinkamai padidinkite ciklo skaičių stiprinimo procese. Arba galima pritaikyti įdėtą PGR arba atlikti vieną ar dvi reakcijas, atitinkamai pratęsiant denatūraciją ir pratęsimo laiką prieš įprastą PGR amplifikaciją, o tai gali padėti išplėsti fragmentus. Atkreipkite dėmesį į polimerazės ištikimybę. 3. Ilgas Taq gali būti naudojamas PCR, kad būtų pasiekti idealūs rezultatai. 4. Taikant baltymų ekspresiją, turėtų būti naudojama aukštos tikslumo polimerazė.
TIANGEN siūlo dviejų tipų atvirkštinę transkriptazę: „Quant/King RTase“ ir „TIANScript M-MLV“. Pagrindinis skirtumas tarp jų yra įvestų šablonų kiekis. „Quant“ yra unikali atvirkštinė transkriptazė, kuri skiriasi nuo dažniausiai naudojamos M-MLV, gautos iš Moloney pelių leukemijos viruso. „Quant“ yra nauja didelio efektyvumo atvirkštinė transkriptazė, kurią rekombinantiškai išreiškia inžinerinė Escherichia coli. „Quant“ tinka 50 ng – 2 μg RNR, turinčios didelį atvirkštinės transkripcijos aktyvumą ir didelį derlių, amplifikavimui. Palyginus su įprastu MMLV arba AMV, didžiausia Quant savybė yra ta, kad jis labai stipriai susilieja su RNR šablonais ir gali pakeisti sudėtingus šablonus be aukšto temperatūros denatūracijos. Šablonų, kuriuose yra didesnis GC kiekis, atvirkštinis efektyvumas yra didesnis. Tačiau ši atvirkštinė transkriptazė turi RNazės H aktyvumą, kuris gali turėti įtakos cDNR produkto ilgiui (tinka <4,5 kb šablonams). Įprastinei atvirkštinei transkripcijai rekomenduojama naudoti TIANScript MMLV atvirkštinę transkriptazę. Ši RTazė yra modifikuotas fermentas, turintis labai silpną RNazės H aktyvumą, kuris tinka ilgai (> 5 kb) cDNR sintezei.
Vieno žingsnio atvirkštinė transkripcija ir PGR amplifikacija atliekama tame pačiame mėgintuvėlyje, neatidarant mėgintuvėlio dangtelio tarp cDNR sintezės ir amplifikacijos, o tai padeda sumažinti užteršimą. Kadangi visi gauti cDNR mėginiai naudojami amplifikacijai, jautrumas yra didesnis, mažiausiai 0, 01 pg visos RNR. Siekiant sėkmingo vieno žingsnio RTPCR, cDNR sintezei pradėti paprastai naudojami genų specifiniai pradmenys. Dviejų etapų metodas, būtent atvirkštinė transkripcija ir PGR amplifikacija, atliekamas dviem etapais. Pirmiausia atvirkštinė transkripcija atliekama iš RNR šablono, kad būtų gauta cDNR, o gauta cDNR yra veikiama vienos ar kelių skirtingų PGR reakcijų. Dviejų žingsnių metodas gali naudoti oligo (dT) arba atsitiktinius pradmenis, kad būtų galima vadinti pirmosios cDNR grandinės sintezę, ir gali atvirkščiai perrašyti visą mRNR informaciją iš konkretaus mėginio.
Produktų kategorijos
KODĖL RINKTIS MUS
Nuo pat įkūrimo mūsų gamykla kuria pirmos pasaulinės klasės produktus, laikydamasi principo
pirmiausia kokybe. Mūsų produktai įgijo puikią reputaciją pramonėje ir patikimumą tarp naujų ir senų klientų.